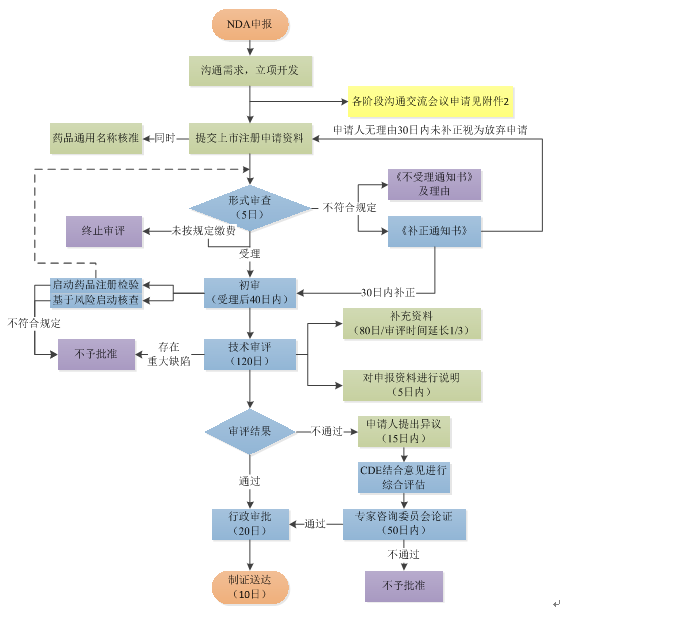
申请人在完成支持药品上市注册的药学、药理毒理学和药物临床试验等研究,确定质量标准,完成商业规模生产工艺验证,并做好接受药品注册核查检验的准备后,提出药品上市许可申请,按照申报资料要求提交相关研究资料。经对申报资料进行形式审查,符合要求的,予以受理。药品注册申请复核法定要求的,予以批准。
|
服务 |
服务内容 |
|
咨询阶段 |
免费提供法规咨询,了解客户需求,进行可行性分析并提供报告,提供服务方案及报价。 |
|
立项阶段 |
与客户达成合作,签订各项合同,成立项目组,制定具体项目实施方案及计划,项目组启动立项。 |
|
申请资料准备 |
根据客户需求,协助整理各阶段实验数据,撰写综述类与总结类申报资料。 |
|
递交申请 |
帮助客户完成递交申请,实时跟进进度并定期汇报。 |
|
注册核查与注册检验 |
协助现场核查及问题整改。 |
|
注册申报后发补 |
指导回复监督机构提出的质疑,指导发补资料撰写等。 |
《化药CTD格式资料模板》
在化学药品领域,我司可提供注册咨询服务;行业年度分析报告调研服务;化学药品相关法规、标准培训;文献、专利等信息检索;协助现场核查及问题整改;预审与撰写注册申报资料等服务,如有需要,可咨询华南新药注册申报服务有限公司。
咨询电话:020-32643645 18027296587
地址1:广州市生物岛寰宇三路36号官洲生命科学创新中心B栋411-412单元
地址2:广州市黄埔区科学城揽月路3号广州国际企业孵化器F区F911室-F919室

邮箱:scprs@sccip.org.cn
电话:020-32643642 18027296587
地址:广州市黄埔区科学城揽月路3号广州国际企业孵化器F区720室、广州市黄埔区科学城揽月路3号广州国际企业孵化器F区911室-F919室