2017年5月5日,欧盟官方期刊(Official Journal of the European Union)正式发布了欧盟医疗器械法规(REGULATION (EU) 2017/745,简称“MDR”)。MDR将取代Directives 90/385/EEC (有源植入类医疗器械指令)and 93/42/EEC(医疗器械指令)。依据MDR Article 123的要求,MDR于2017年5月26日正式生效,并与2020年5月26日期正式取代MDD(93/42/EEC)和AIMDD(90/385/EEC)。
2020年4月3日,2020年4月3日,欧洲委员会通过了一项提议Commission postpones application of the Medical Devices Regulation to prioritise the fight against coronavirus(欧盟委员会推迟实施《医疗器械法规》以优先对抗冠状病毒),将《医疗器械法规》的适用日期推迟一年,以允许成员国,卫生机构和经济运营商优先应对冠状病毒大流行。由于新型冠状病毒的特殊原因,提议将法规的实施推迟了一年-2021年5月26日。该提议不会影响《体外诊断医疗器械法规》的适用日期,该法规将于2022年5月26日生效。
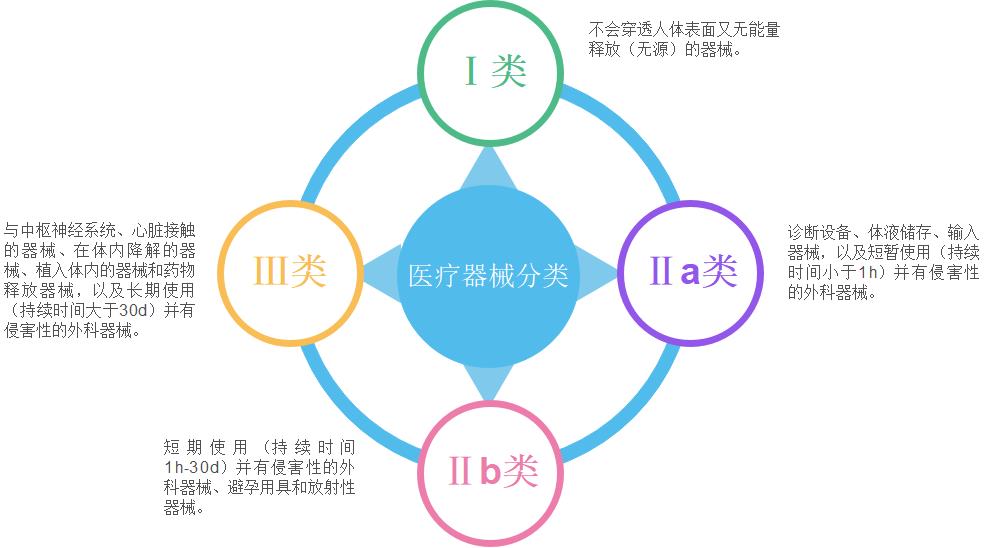
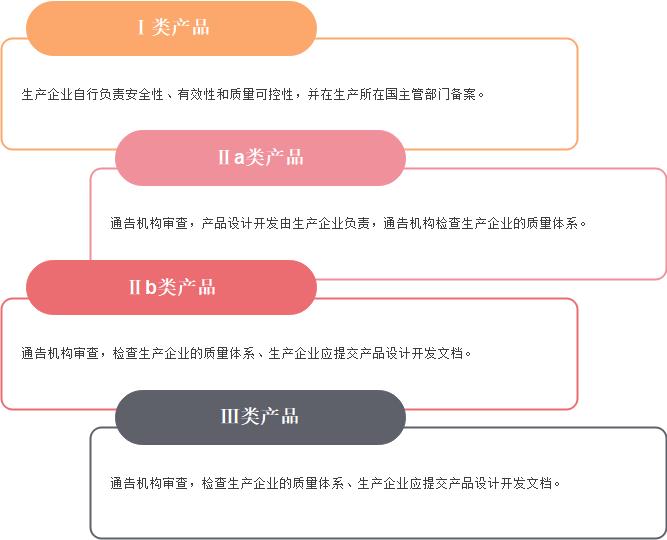
欧盟根据医疗器械的预期用途和风险,将医疗器械分为Ⅰ、Ⅱa、Ⅱb和Ⅲ类。


邮箱:scprs@sccip.org.cn
电话:020-32643642 18027296587
地址:广州市黄埔区科学城揽月路3号广州国际企业孵化器F区720室、广州市黄埔区科学城揽月路3号广州国际企业孵化器F区911室-F919室