创新医疗器械申请的前提条件:
(1)有专利:申请人通过其主导的技术创新活动;在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;创新医疗器械特别审查申请时间距专利授权公告日不超过5年。或者核心技术发明专利的申请已由国务院专利行政部门公开,并由国家知识产权局专利检索咨询中心出具检索报告,报告载明产品核心技术方案具备新颖性和创造性。
(2)有产品:申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
(3)有创新:产品主要工作原理或者作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,且具有显著的临床应用价值。
无官方费用。
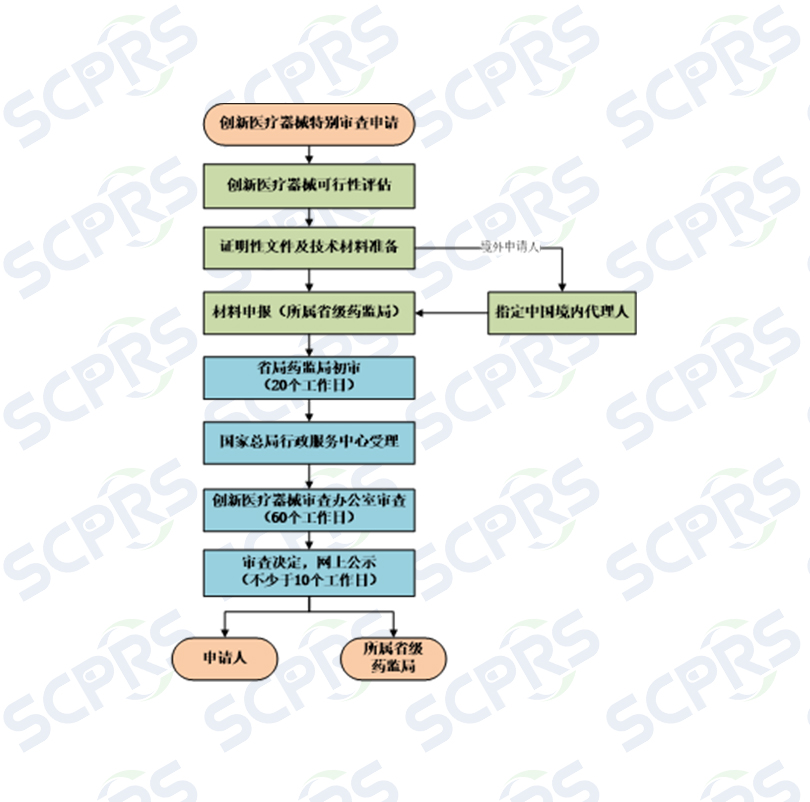
--创新医疗器械特别审查标准操作流程(SCPRS-MD-SOP-008-01)
--创新医疗器械特别审查程序符合情况评估标准操作流程(SCPRS-MD-SOP-009-01)
--创新医疗器械申请资料模板
文件来源:广州华南新药注册申报服务有限公司
在医疗器械领域,我司可提供注册咨询服务;行业年度分析报告调研服务;医疗器械相关法规、标准培训;文献、专利等信息检索;协助现场核查及问题整改;预审与撰写注册申报资料等服务,如有需要,可咨询广州华南新药注册申报服务有限公司。
咨询电话:020-32643645 18028674076
地址1:广州市生物岛寰宇三路36号官洲生命科学创新中心B栋411-412单元
地址2:广州市黄埔区科学城揽月路3号广州国际企业孵化器F区F911室-F919室

邮箱:scprs@sccip.org.cn
电话:020-32643642 18027296587
地址:广州市黄埔区科学城揽月路3号广州国际企业孵化器F区720室、广州市黄埔区科学城揽月路3号广州国际企业孵化器F区911室-F919室