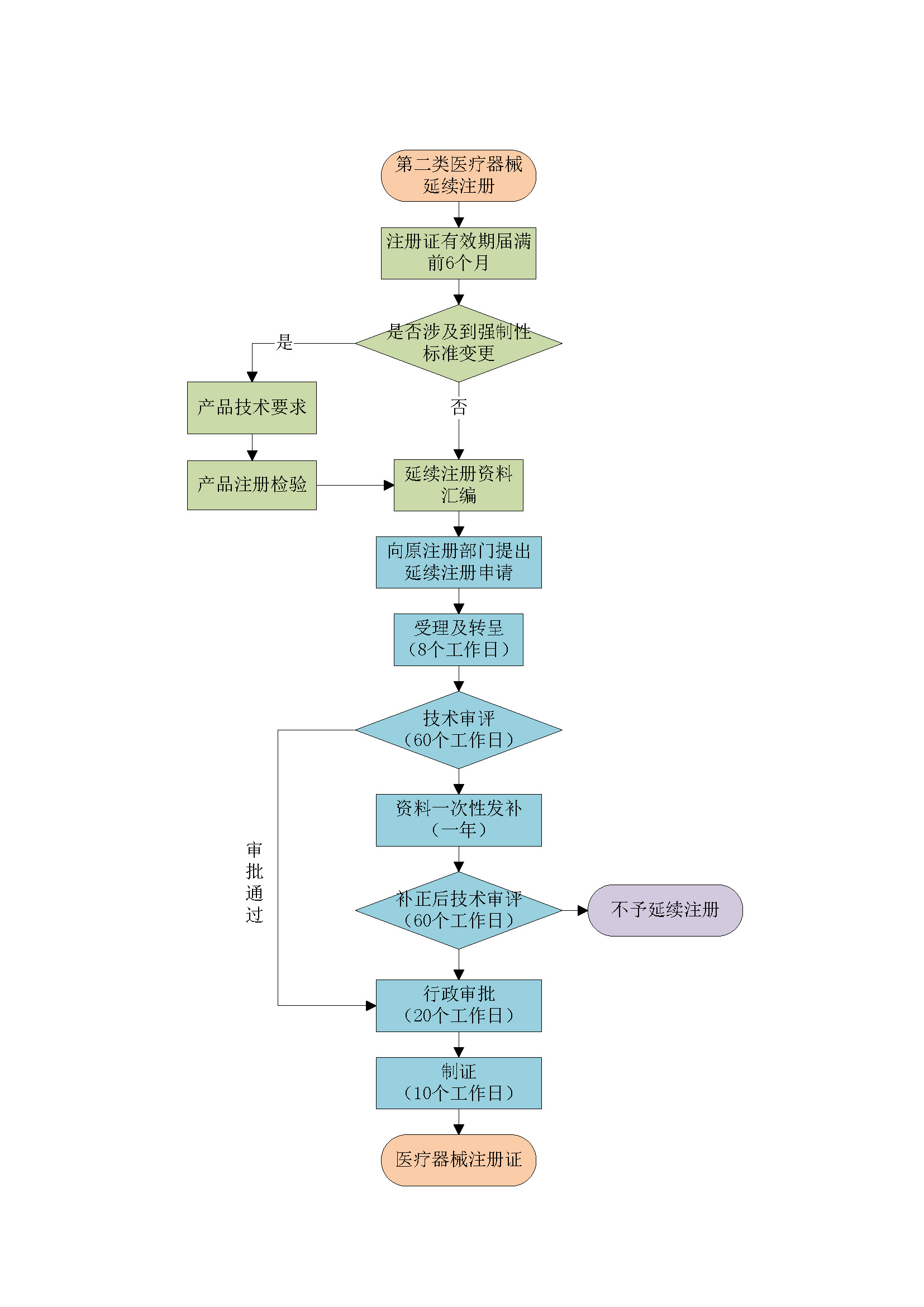
根据《医疗器械注册与备案管理办法》第八十二条 医疗器械注册证有效期届满需要延续注册的,注册人应当在医疗器械注册证有效期届满6个月前,向原注册部门申请延续注册,并按照相关要求提交申请资料。
国产第二类医疗器械向所在地省、直辖市、自治区药品监督管理局提出延续注册申请,进口第二类医疗器械向国家药品监督管理局提出延续注册申请。
|
阶段 |
服务内容 |
时间预估 |
|
咨询阶段 |
l 免费提供法规和产品咨询,了解客户需求,提供咨询服务方案及报价,产品可行性分析报告(根据客户需求)。 |
5个工作日 |
|
立项阶段 |
l 确定客户需求,签订合同,成立项目组,制定变更注册方案及计划,项目组启动立项。 |
15个工作日 |
|
延续注册资料准备
|
l 提供模板,按照SOP协助客户完成变更注册资料准备。 注:产品是否需要检验视产品情况而定,增加型号规格、涉及到产品技术要求中性能指标的变化需要进行注册检验。 |
视产品情况而定 |
|
延续注册申请
|
l 帮助客户完成变更注册和发补,与审评中心进行沟通交流,跟进变更注册进度并定期汇报。 注:时间预估=官方审批(158个工作日,约8个月)+产品发补(12个月,视产品情况而定) |
10~20个工作日 |
|
延续注册后跟进及发补
|
|
各省、直辖市、自治区国产第Ⅱ类医疗器械延续注册收费标准 |
||||||||
|
省份 |
北京 |
天津 |
河北 |
山西 |
内蒙古 |
辽宁 |
吉林 |
黑龙江 |
|
费用(¥) |
0 |
0 |
30000 |
16275 |
0 |
21000 |
0 |
24000 |
|
|
||||||||
|
省份 |
上海 |
江苏 |
浙江 |
安徽 |
福建 |
江西 |
山东 |
河南 |
|
费用(¥) |
27300 |
24570 |
21840 |
20790 |
23900 |
22680 |
34100 |
0 |
|
|
||||||||
|
省份 |
湖北 |
湖南 |
广东 |
广西 |
海南 |
重庆 |
四川 |
贵州 |
|
费用(¥) |
0 |
21000 |
23800 |
31400 |
34100 |
0 |
16500 |
17600 |
|
|
||||||||
|
省份 |
云南 |
西藏 |
陕西 |
甘肃 |
青海 |
宁夏 |
新疆 |
|
|
费用(¥) |
17500 |
/ |
0 |
0 |
/ |
6500 |
0 |
|
|
国家药品监督管理局进口第Ⅱ类医疗器械延续注册收费标准 |
|
|
类别 |
进口第Ⅱ类 |
|
费用(¥) |
40800 |
--第二类医疗器械延续注册申报资料汇编标准操作流程(SCPRS-MD-SOP-024-01)
--第二类医疗器械延续注册申报标准操作流程(SCPRS-MD-SOP-025-01)
--第二类医疗器械延续注册申请资料模板
--第二类医疗器械延续注册补充资料模板
文件来源:广州华南新药注册申报服务有限公司
咨询电话:020-32643645 18028674076
地址1:广州市生物岛寰宇三路36号官洲生命科学创新中心B栋411-412单元
地址2:广州市黄埔区科学城揽月路3号广州国际企业孵化器F区F911室-F919室

邮箱:scprs@sccip.org.cn
电话:020-32643642 18027296587
地址:广州市黄埔区科学城揽月路3号广州国际企业孵化器F区720室、广州市黄埔区科学城揽月路3号广州国际企业孵化器F区911室-F919室