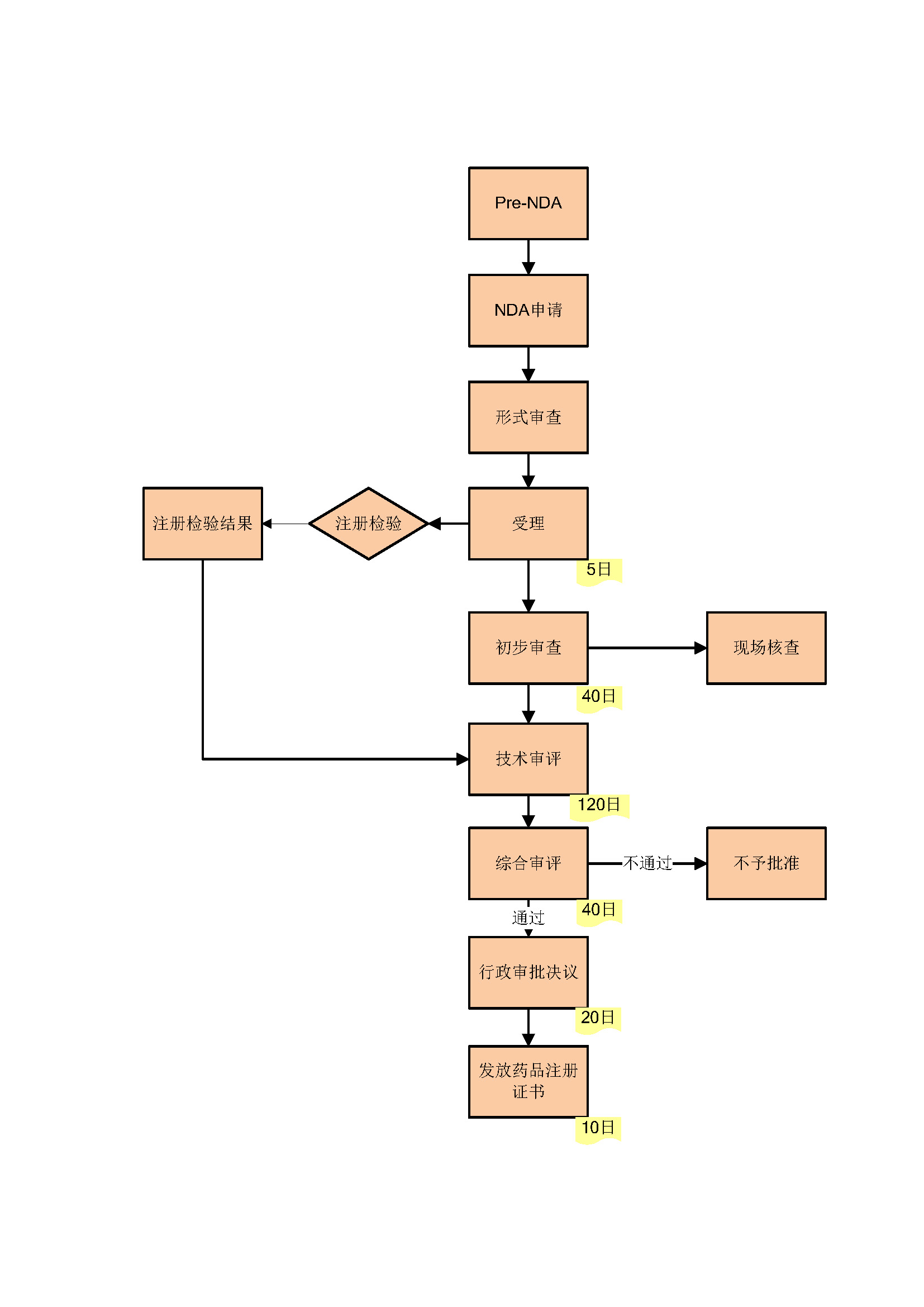
按照生物制品管理的体外诊断试剂包括用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂等,分为1类:创新型体外诊断试剂和2类:境内外已上市的体外诊断试剂。申请人在境内完成临床试验后可以直接提出药品上市许可申请。
《药品注册管理办法》(局令27号)
《生物制品注册分类及申报资料要求》
《生物制品注册受理审查指南(第三部分 按生物制品管理的体外诊断试剂)(试行)》
《药品注册核查检验启动工作程序(试行)》(2021年第54号)
《药品注册核查工作程序》(2021年第30号)
《药品注册核查检验启动原则和程序管理规定(试行)》
《药品注册检验工作程序和技术要求规范(试行)》
如有需要可联系华南新药注册申报服务有限公司。
咨询电话:020-32643645 18027296587
地址1:广州市生物岛寰宇三路36号官洲生命科学创新中心B栋411-412单元
地址2:广州市黄埔区科学城揽月路3号广州国际企业孵化器F区F911室-F919室

邮箱:scprs@sccip.org.cn
电话:020-32643642 18027296587
地址:广州市黄埔区科学城揽月路3号广州国际企业孵化器F区720室、广州市黄埔区科学城揽月路3号广州国际企业孵化器F区911室-F919室